HIPERPLASIA SUPRARRENAL CONGENITA: 17 alfaOH PROGESTERONA NEONATAL
Ver: Introducción a Screening Neonatal
Método: AUTODELFIA
Muestra: Mancha de sangre seca recogida sobre papel de filtro aprobado (Scheleider e Schuell # 903 o Whatman BFC 180). La muestra debe ser tomada preferentemente del talón del bebé. Secar a temperatura ambiente. La sangre debe saturar por completo el papel de filtro. La muestra se toma entre el 2° y 6° día de vida. En recién nacidos pretérmino o críticamente enfermos se obtendrá la muestra al séptimo día de vida. El uso de EDTA como anticoagulante interfiere con la metodología.

Valor de referencia:
Recién nacidos entre 1100 y 3500 g de peso al nacer < 30 nmol/l.
Recién nacidos con peso < 1100 g <150 nmol/l
Recién nacidos con peso 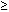 3500
g < 30 nmol/l
3500
g < 30 nmol/l
Se hallan niveles elevados de 17 hidroxiprogesterona, normalmente en niños prematuros. El estrés de enfermedades comúnmente presentes en estos prematuros, estimulan la síntesis de esteroides Esto lleva a una disminución de la especificidad en niños prematuros, aumentando el número de falsos positivos.
El cut off se toma ajustando los valores según la edad gestacional para disminuir el número de falsos positivos.
Incidencia: la forma perdedora de sal tiene una incidencia de 1/5058 y la forma virilizante simple tiene una incidencia de 1/20230.
Significado clínico:
la hiperplasia suprarrenal congénita(HSC) es uno de los desórdenes adrenales más frecuentes en la infancia.
La enfermedad se hereda en forma autosómica recesiva y está caracterizada por deficiencia de actividad de una de las enzimas necesarias para la síntesis de cortisol adrenal.
La mayoría de los casos (más de un 90 %) se debe a déficit de la enzima 21 hidroxilasa.
Para diagnosticar la enfermedad, se dosa la 17 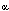 -
OH Progesterona, el metabolito mayoritario que se acumula en infantes
afectados de HSC debido a déficit de 21 hidroxilasa.
-
OH Progesterona, el metabolito mayoritario que se acumula en infantes
afectados de HSC debido a déficit de 21 hidroxilasa.
Desde el punto de vista clínico-bioquímico, el d&iecute;ficit de 21-Hidroxilasa posee distintas formas de presentación:
- 1- Forma perdedora de sal: se presenta con un déficit tanto de glucocorticoides como de mineralocorticoides, observándose una excesiva producción de andrógenos.
- 2- Forma virilizante simple: a diferencia de la forma anterior no se manifiestan pérdidas de sodio en orina ni hipercalemia, sugiriendo que los pacientes afectados controlan la producción de mineralocorticoides.
- 3- Forma no clásica o tardía: su principal signo clínico es la aparición de hirsutismo en la adolescencia.
- 4- Forma asintomática o críptica. Carece de manifestaciones clínicas.
El diagnóstico clínico de HSC es pobre en el período neonatal. En más de 2/3 partes de los infantes con HSC, tienen alterada la síntesis de mineralocorticoides, que puede amenazar la vida del paciente por crisis de pérdida salina en las primeras semanas de vida.
Los varones tienen un riesgo mayor de padecer estas crisis debido a que no se sospecha el diagnóstico. Se considera que debe realizarse el screening debido al excesivo número de pacientes femeninos vivos, lo cual sugiere que los niños son subdiagnosticados y mueren en la infancia. Además la virilización encontrada en las niñas, puede ser lo suficientemente severa como para llevar a asignación incorrecta del sexo. Los andrógenos adrenales producen precocidad sexual y somática. En forma post natal, ambos sexos manifiestan un crecimiento somático rápido, con maduración esquelética acelerada, cierre temprano de las epífisis y baja estatura en la vida adulta. Además las niñas afectadas tienen problemas de fertilidad.
El tratamiento suprime el patrón esteroide anormal y evita las consecuencias del exceso de virilización, la baja estatura y el déficit de cortisol.
Utilidad clínica:
- · Diagnóstico de HSC en varones con riesgo de padecer una crisis de pérdida salina.
- · Diagnóstico de HSC en niñas virilizadas para prevenir una incorrecta asignación del sexo.
El objetivo principal del tratamiento consiste en lograr que el organismo sea capaz de mantener un balance adecuado de sales y agua, alcanzando parámetros normales de crecimiento, maduración sexual y fertilidad en la vida adulta.
El control del progreso del tratamiento se realiza mediante evaluaciones clínicas y monitoreos periódicos que permiten ajustar la dosis de la medicación.
Bibliografía:
1. T. Torresani, A. Grutes, R. Scherz, J.J. Burckhardt, A. Harras, M.
Zachmann. Screening, 3 (1994) 77-84. Improving the efficacy of newborn
sxcreeningfor congenital adrenal hyperplasia by adjusting the cut off
level 17 alfa hydroxiprogesterone to gestational age.
2. David B. Allen , MD Gary, L. Hoffman, Patrick Fitzpetrick, Ronald Laessig,
PhD, Sharon Maly, MD and Arnold Slyper, MD. The journal of pediatrics.
January 1997. Volume 130, number 1. Improved precidion of newborn screening
for congenital adrenal hyperplasia using weigh adjusted criteria for 17
hydroxyprogesterone levels.