|
ANTIGENO PROSTATICO ESPECIFICO (PSA)
Método: IRMA, EIA, quimioluminiscencia.
Muestra: suero o plasma (EDTA)
Valor de referencia: hasta 4,0 ng/ml
Vida media: 2-3 días
Significado clínico:
El antígeno prostático específico (PSA) es una
serino-proteasa perteneciente a la familia de las kalicreínas que,
aparentemente, sólo se origina en el epitelio prostático
(normal, adenomatoso y maligno) y es secretada al fluido seminal. Sin
embargo con metodologías más sensibles, como las empleadas
en inmunohistoquímica, se ha detectado PSA en tumores de mama,
pulmón, colon, ovario, hígado, riñón, adrenal,
paratiroides, tumor de piel y glándulas salivales.
El PSA tiene acción lítica y su función es el clivado
de la semenogelina, principal proteína del coagulo seminal, permitiendo
la licuefacción del mismo a fin de facilitar la motilidad espermática.
El PSA no presenta variación diurna aunque existe gran variabilidad
individual.
En suero forma complejos con varios inhibidores de proteasas, circulando
en diferentes formas moleculares:
| Formas moleculares |
Sigla |
Descripción |
| PSA- total |
PSA-t |
Son todas las formas inmunodetectables en suero. Principalmente
PSA-l y PSA-ACT |
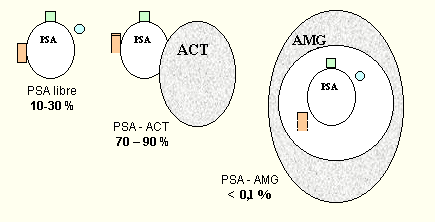
PSA libre
10-30 % |
PSA-l |
Es el PSA no complejado. Su acción proteásica
es inactiva en suero. |
| |
PSA-ACT (70-90%)
|
Es el PSA unido en forma covalente a la  1-antiquimotripsina.
Es la mayor forma inmunodetectable. 1-antiquimotripsina.
Es la mayor forma inmunodetectable. |
| |
PSA-AMG (menos del 0,1%)
|
Es el PSA unido y encapsulado por la  2-macroglobulina.
No es inmunodetectable. 2-macroglobulina.
No es inmunodetectable. |
| |
PSA-PCI
|
Es el PSA unido covalentemente al inhibidor de la proteína
C y no es detectable en suero |
| |
PSA-AT
|
Es el unido a la  1-antitripsina.
Se encuentra en trazas en circulación. 1-antitripsina.
Se encuentra en trazas en circulación. |
| |
PSA-IT
|
Es el PSA unido al inhibidor inter a tripsina. Se halla
en trazas en suero. |
Los métodos disponibles en el comercio pueden evaluar el PSA-l,
el PSA-t (PSA-l +PSA-ACT) y el PSA complejado (PSAc).
El conocimiento del PSA complejado (ver
PSA complejado), el PSA-l y sus relaciones con el PSA total generó
la necesidad de un ensayo equimolar para el PSA total. Conceptualmente
el ensayo equimolar para PSA total debe medir el mismo valor de PSA independientemente
de cual sea la relación PSAc:PSA-l
Los ensayos no equimolares generalmente sobrestiman PSA libre. Los ensayos
estandarizados contra proporción 90:10 (PSA-ACT:PSA libre) no son
equimolares y los resultados no correlacionan para las distintas concentraciones
de las isoformas. En 1994 el NCCLS acordó la necesidad de un ensayo
equimolar para PSA total y en mismo año la Segunda Conferencia
Internacional en la Estandarización del PSA recomendó que
la estandarización de los ensayos se debía hacer contra
un estándar que contenga 90% de PSA-ACT y 10% de PSA-l.
Formas predominantes de PSA sérico ( PSA libre y PSA–ACT
) inmunológicamente detetectadas.
Utilidad Clínica:
1-Screening para cáncer de próstata en pacientes
asintomáticos mayores de 50 años de edad junto con el examen
digital rectal y/o ecografía transrectal.
La Asociación Americana de Urología y la Sociedad de Cáncer
Americana recomiendan un control prostático anual, en hombres asintomáticos
mayores de 50 años de edad, por medio del examen digital rectal
y la determinación de PSA.
Los tumores localizados se detectan con una sensibilidad del 50-60% efectuando
sólo el examen digital y del 70-80% en el caso de la medición
aislada del PSA. Los estudios multicéntricos determinaron que el
uso conjunto de ambas técnicas aporta un adicional del 15-20% de
sensibilidad en la detección, respecto de cada una de las técnicas
por separado.
Para incrementar la eficiencia en el rastreo poblacional se propusieron
distintos indicadores:
- a) Determinar la densidad de PSA: relación concentración
de PSA/ volumen prostático, (PSAD) ya que la cantidad de PSA
secretada al torrente circulatorio es dependiente de la cantidad de
tejido prostático, es decir del volumen de la glándula
que se determina por ecografía transrectal. El valor del PSA
normal debería corresponder al 10% de dicho volumen.
Una densidad mayor o igual a 0,15 implica probabilidad de cáncer
de próstata (Valor de Predicción Postivo (VPP) cercano
al 35%) que debe ser confirmado con una biopsia. El PSAD menor a 0,10
indicaría una probabilidad menor al 10% de la existencia de neoplasia.
- b) Determinar el incremento de PSA en un período de tiempo
(velocidad) (PSAV), generalmente se considera un período de 1
año. Un incremento > 0,8 ng/ml/año se asocia a cáncer
de próstata con una sensibilidad clínica del 90% y una
especificidad del 90-100%. Es oportuno aclarar que si se parte de valores
iniciales muy dispares resultarán cifras finales muy diferentes
al incrementar 0,8 ng/ml ( para un valor inicial de 5 ng/ml será
5,8 ng/ml y para uno de 20 ng/ml, será 20,8 ng/ml) y ello no
dará idea de la real evolución. Por eso se ha propuesto
considerar un incremento del 20% anual sobre el valor inicial.
- c) Emplear intervalos de referencia específicos para la edad.
El intervalo definido por décadas incrementa la sensibilidad
del PSA en hombres menores de 50 años y la especificidad en hombres
mayores de 70 años, edad ésta en que son más frecuentes
los problemas prostáticos, evitando en ellos biopsias innecesarias.
Los intervalos propuestos por la Mayo Clinic USA son lo siguientes:
- 40-49 años:
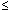 2,5 ng/ml 2,5 ng/ml
- 50-59 años:
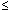 3,5 ng/ml 3,5 ng/ml
- 60-69 años:
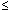 4,5 ng/ml 4,5 ng/ml
- 70-79 años:
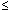 6,5 ng/ml (1)(6) 6,5 ng/ml (1)(6)
2- Diagnóstico: El PSA constituye el marcador más
útil para el diagnóstico del adenocarcinoma de próstata.
Sin embargo presenta algunas limitaciones:
- · No es específico de órgano, se la encuentra
en bajas concentraciones en varios tejidos, como asimismo en leche materna
y líquido amniótico.
- · No es tumor-específico: es posible encontrar concentraciones
similares de PSA séricas en pacientes con hiperplasia benigna
prostática (HBP) y en los estadíos iniciales del carcinoma
de próstata (CP).
Puede encontrarse elevado en entidades benignas y puede estar normal
en pacientes con adenocarcinoma prostático localizado. Valores
entre 4,0 y 10,0 ng/ml pueden hallarse en pacientes con HPB con una prevalencia
de 21-86% dependiendo de la edad y de la extensión de la lesión.
En consiguiente, la mayor problemática referida a la patología
prostática consiste en poder diferenciar la HBP del CP, especialmente
cuando los valores de PSA se encuentran en la zona gris entre 4 y 10 ng/ml.
Para estos casos se han realizado numerosos estudios donde ha sido demostrada
la menor relación PSA libre/PSA total, en pacientes con cáncer
de próstata. Se postula que este cociente permite discriminar con
mayor eficiencia a la HBP del CP.
La difusión de PSA-l al torrente circulatorio prevalece en la HBP,
mientras que en la malignización existe mayor secreción
de PSA activo que promueve la formación de complejos y por ende
hay menor cantidad de PSA-l, y la relación PSA-l/PSA-t será
significativamente menor en el paciente con cáncer.
En recientes publicaciones el valor de corte propuesto oscilaría
entre 0,15-0,19 según la metodología empleada, los pacientes
que no presentan evidencia de enfermedad maligna suelen tener valores
por encima de 0,21. El cociente PSA-l/PSA-t ha resultado más eficaz
en la distinción de HBP y CP que el PSAD y PSAV.
La eficacia diagnóstica de esta relación es del 77%, con
una sensibilidad del 78% y 92.7% de especificidad, hecho que reduce notablemente
el número de biopsias innecesarias.
3-Monitoreo del tratamiento local y/o sistémico y del curso
clínico en pacientes con cáncer de próstata. Se recomienda
efectuar determinaciones seriadas con intervalos no menores a 3-4 vidas
medias del marcador.
4-Recidivas: detección de recurrencia de adenocarcinoma
en pacientes post quirúrgicos y pacientes tratados con terapia
radiante. Elevados niveles de PSA pueden preceder en 6 a 12 meses a las
metástasis clínicamente evidentes. El 95% de los pacientes
con metástasis óseas presentan valores superiores a los
100 ng/ml de PSA total.
Variables preanalíticas:
La concentración de PSA es alta al nacer pero disminuye a niveles
no dosables alrededor de los 6 meses, reaparece alrededor de los 10 años
de edad y se incrementa hasta alcanzar los niveles del adulto después
de la pubertad.
Existen grandes variaciones intraindividuales (16-24% de coeficiente de
variación).
Disminuido:
Posición supina
Aumentado:
Edad (en el hombre), ejercicio físico, cateterización, manipulación
prostática (examen digital rectal, instrumentación endoscópica,
biopsia prostática, etc.) produce un incremento una o dos veces
superior al nivel basal tomadas las muestras una hora después del
exámen. Cabe aclarar que existe cierta controversia sobre estos
conceptos. Post- eyaculación (se ha observado un incremento de
los niveles de PSA producto del acto sexual, con una disminución
a las 24 hs, no compatible con la vida media del PSA).
Variables por enfermedad:
Aumentado:
Prostatitis aguda bacteriana (incrementa notoriamente el nivel plasmático
que luego de 1 o 2 meses retorna a niveles normales), obstrucción
urinaria.
Variables por drogas:
Disminuido:
Finasteride, flutamida, acetato de ciproterona, drogas que causan deprivación
androgénica.
IMPORTANTE: No se deben realizar seguimientos en distintos laboratorios.
La comparación entre valores de PSA obtenidos en laboratorios diferentes,
con kits distintos es usualmente pobre.
Bibliografía:
1- LotharT. Clinical Laboratory Diagnostics: Use and assessment of clinical
laboratory results, English edition, 1998.
2- Tietz N. W. Clinical Guide to Laboratory test, edited by W.B. Saunders
Company, third edition, United States of America ,1995.
3- Young D. Effects of Preanalytical Variables on Clinical Laboratory
Test. AACC, second edition, 1997
4- Lehmann C. A. Saunders Manual of Clinical Laboratory Science, W.B.Saunders
Company, Philadelphia, first edition 1998.
5- Ravel R. Clinical Laboratory Medicine. Clinical application of Laboratory
Data. Mosby editorial, sixth edition, United States of America, 1995.
6- Young D. Effects of Drugs on Clinical Laboratory Test, AACC, third
edition, 1990.
7- Wu J. and Nakamura R. Human Circulating tumor markers. Current Concepts
and Clinical Applications. American Society of Clinical Pathologists,
Chicago, 1997.
8- Klaus, Brux, Lein et al. Molecular Forms of Prostate-Specific Antigen
in Malignant and Benign Prostatic Tissue: Biochemical and Diagnostic Implications.
Clin Chem 2000; 46:47-54.
|