|
PTH - PARATHORMONA
Sinonimia: PTH, hormona paratiroidea
Metodología: Irma, quimioluminiscencia, ECLIA.
Muestra: suero o plasma. Separar en centrifuga refrigerada.
Suero debe ser almacenado a –20ºC dentro de las 2 horas de recolección.
EDTA, en ayuno, por la mañana. En pacientes dializados debe ser
recolectado antes de la diálisis.
A temperatura ambiente en suero o sangre entera 6 horas.
Valor de referencia:
Molécula intacta: 10-65 pg/ml
C-terminal (suero):
1-16 años: 51-217 pg/ml
adultos: 50-300 pg/ml
N-terminal (suero):
2-13 años: 14-21 pg/ml
adultos: 8-24 pg/ml
Significado clínico:
La PTH es un péptido de 84 aminoácidos que proviene
de la preproparathormona (115 aminoácidos).
La heterogeneidad de la PTH circulante es consecuencia de la secreción
por la paratiroides de la forma intacta (PTH-i) y de fragmentos inactivos
y del metabolismo periférico de la forma intacta resultando principalmente
en los fragmentos amino terminal (PTH-N terminal), carboxilo terminal
(C-terminal) y molécula media.
- PTH intacta (PTH-i): aminoácidos 1-84, vida media 5 minutos,
es la forma molecular que se halla en menor proporción, y tiene
el mayor grado de actividad. Es la forma biológicamente activa.
- PTH C-terminal: carboxilo terminal, aminoácidos 53-84 vida
media 30 minutos. Función indeterminada, puede tener impacto
en la diferenciación osteoclástica.
- PTH molécula media: aminoácidos 44-68; 35-64. Es adecuada
para hiperparatiroidismo primario y es la que mejor correlaciona con
esta patología. No es útil para casos de hipoparatiroidismo,
ni casos de enfermedades malignas.
- PTH N-terminal: amino terminal, aminoácidos 1-34, vida media
1-2 minutos.
Sólo la PTH intacta y la N-terminal poseen actividad biológica.
El péptido C-terminal y la molécula media constituyen el
90% de la PTH circulante. Estos fragmentos son aclarados por el riñón
e hígado y tienen una vida media aproximada de 1-2 horas, por lo
que se encuentran en mayor concentración.
La PTH regula el calcio y el fosfato a través de:
- Estimular la resorción ósea causando liberación
tanto de calcio como de fosfato. La PTH no ejerce un efecto directo
sobre el osteoclasto maduro sino a través de su unión
a los receptores osteoblásticos de PTH. La PTH no sólo
promueve la proliferación celular de la célula osteoblástica
sino también incrementa la síntesis de colágeno
tipo 1, por lo tanto además del efecto resortivo óseo,
la PTH tiene un efecto osteo- anabólico.
- Activar la 1
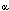 -hidroxilasa renal, resultando
en una síntesis incrementada de 1,25 (OH)2 D3;
esto conduce a una incrementada absorción intestinal de calcio
y fosfato. -hidroxilasa renal, resultando
en una síntesis incrementada de 1,25 (OH)2 D3;
esto conduce a una incrementada absorción intestinal de calcio
y fosfato.
- En el riñón inhibe la bomba sodio/fosfato en la membrana
de la célula tubular. Estimula el transporte de calcio o la reabsorción
en el túbulo distal de la nefrona e inversamente la PTH disminuye
la reabsorción de fosfato en el túbulo proximal, resultando
en fosfaturia.
En el plasma estos efectos resultan en un ascenso del calcio y una declinación
del fosfato.
Para la unión de la PTH a su receptor, sólo son necesarios
34 aminoácidos. El receptor ha sido detectado en hueso, riñón,
cerebro y páncreas.
La secreción de PTH es regulada primariamente por la concentración
de calcio libre en sangre o fluido extracelular. La 1,25 (OH)2
D3 en circulación, el magnesio, fosfato y las catecolaminas
han sido reportadas de influenciar la secreción de PTH.
Estados hipocalcémicos y de deficiencia de vitamina D estimulan
la secreción de PTH y la hipercalcemia o altas concentraciones
de vitamina D causan la inhibición.
La hipomagnesemia severa crónica, y el alcoholismo han sido asociados
con una secreción defectuosa de PTH, mientras que la hipomagnesemia
aguda puede estimular su secreción. La hipermagnesemia suprime
la secreción de PTH aunque no tan efectivamente como el calcio.
La 1,25 (OH)2D interactúa con los receptores de vitamina
D en la glándula paratiroidea para suprimir crónicamente
la síntesis de PTH. La administración de fosfatos estimula
la secreción de PTH, sin embargo este efecto puede ser explicado
por el descenso del calcio libre. Las catecolaminas incrementan la secreción
de PTH por interactuar con receptores beta adrenérgicos.
La PTH mantiene la concentración de calcio extracelular, previniendo
la hipocalcemia. Aumenta la reabsorción de calcio y magnesio, disminuye
la reabsorción renal de fosfato; aumenta la salida de calcio desde
el hueso hacia el líquido extracelular.
Existe una relación sigmoidea entre el calcio libre en sangre y
la PTH. Se denomina “set point” a la concentración de
calcio capaz de reducir la concentración de PTH a la mitad.
Las medidas de parathormona siempre se deben interpretar en conjunto con
los valores de calcio.
Fisiológicamente con concentraciones de calcio normal, los niveles
de PTH están en el límite inferior del rango de referencia.
Pacientes con insuficiencia renal crónica tendrán aumento
en la concentración de la porción carboxilo terminal y PTH
molécula media aunque no tengan enfermedad paratiroidea debido
a su mayor vida media y su menor aclaramiento de circulación. Es
por eso que se recomienda el dosaje de PTH-i.
En individuos normales y en hiperparatiroideos predominan las fracciones
carboxilo terminal y parathormona molécula media.
La determinación de PTH-i en combinación con la medida de
calcio y fósforo en suero es un factor importante en la diferenciación
de desórdenes del metabolismo del calcio.
Una concentración de PTH-i mayor de 60 pg/ml en combinación
con hipercalcemias indica la presencia de hiperparatiroidismo primario.
El hiperparatiroidismo secundario representa un estadio adaptativo con
una excesiva función paratiroidea.
Las causas más frecuentes incluyen:
- Deficiencia de vitamina D y calcio por ejemplo debido a una síndrome
de malabsorción crónico, como enfermedad celíaca.
- Con falla renal.
En algunos pacientes con falla renal un ascenso en los niveles de PTH-i
es visto en conjunto con una reducción de la VFG de 90-60 ml/min.
En el estadio temprano de la falla renal una disminución en la
concentración de 1,25(OH)2 D3 a pesar de
una PTH-i incrementada sugiere una regulación anormal de la biosíntesis
de 1,25(OH)2D3.
Los niveles de PTH son tan altos como 200 pg/ml en los casos de falla
renal moderada mientras en la falla renal severa puede ascender a 400
pg/ml y en casos severos aún mayor.
El hipoparatiroidismo paratirogénico es raro y puede ocurrir luego
de un procedimiento quirúrgico por ej: cirugía de paratiroides
o tiroides o ser de naturaleza idiopática por ejemplo debido a
un proceso autoinmune.
El pseudohipoparatiroidismo está caracterizado por la presencia
de resistencia a la PTH. La concentración de PTH-i es mayor a 60
pg/ml, al calcio sérico está disminuido y el fosfato incrementado.
Hay 2 tipos de pseudohipoparatiroidismo que pueden ser diferenciados:
- -tipo I, defecto en la adenilato ciclasa (no hay síntesis de
AMPc), no hay un ascenso en la excreción de AMPc y fosfato.
- -tipo II: la transmisión de la señal de AMPc al riñón
y la célula ósea es defectuosa (incrementada excreción
de AMPc y no de fosfato).
La PTH intacta es medida directa de la función de la glándula
paratiroides y es independiente de la función renal.
Utilidad clínica:
- Evaluación de la hipercalcemia. En la diferenciación
de hipercalcemia por otras causas como intoxicación con vitamina
D, neoplasias y enfermedades crónicas.
- Seguimiento del tratamiento
del hiperparatiroidismo secundario en la insuficiencia renal crónica.
La comparación de muestras pre y postdiálisis: ha sido
sugerido para determinar la respuesta aguda a las alteraciones de los
niveles de calcio.
- Diagnóstico diferencial de hipercalcemias. La concentración
de PTH mayor a 60 pg/ml en combinación con hipercalcemias indica
la presencia de hiperparatiroidismo primario.
- Diagnóstico diferencial de hipocalcemias.
- Evaluación y pronóstico de la función paratiroidea
en pacientes con falla renal (PTH-i).
- Evaluación de la función paratiroidea en pacientes con
desórdenes del metabolismo óseo y mineral.
Pacientes con osteítis fibrosa debido a hiperparatiroidismo secundario
tienen niveles elevados de PTH, mientras pacientes con osteomalacia
tienen niveles disminuidos. Niveles intermedios se encuentran en pacientes
con anemia aplásica con bajo “turn-over·” y
en osteítis fibrosa temprana. Considerable solapamiento en los
niveles de PTH-i es observado en pacientes con osteodistrofia.
PTH- molécula media:
- Diagnóstico diferencial de hiperparatiroidismo primario en
ausencia de falla renal.
Variables preanalíticas:
Aumentado:
Fractura ósea, raza: se observa mayor aumento en embarazadas de
raza negra que en blanca y en asiática que en caucásica,
uremia, ejercicio, ritmo circadiano (ascenso nocturno), edad (incremento
con la edad), vegetarianas, se incrementa en los primeros días
de vida.
Disminuido:
Almacenamiento de la muestra: 2-4 horas en el freezer luego de la separación
causa una pérdida del 4-8 %; demorar 2-4 horas en la separación
produce un descenso del 6% en la PTH-i, el 15% de la actividad se pierde
en 3 horas a 25ºC, pérdida de peso, embarazo (normal/ bajo),
feto, sangre de cordón, plasma (5-10% menores que en suero).
Variable por enfermedad:
Aumentado:
Pseudohiperparatiroidismo, déficit de vitamina D, resistencia a
la vitamina D, síndrome de Zollinger Ellison, fluorosis, pseudogota,
carcinoma medular de tiroides, pancreatitis aguda, insuficiencia renal
crónica, acidosis tubular renal proximal y distal, enfermedad celíaca,
alcoholismo crónico, enfermedad aguda, MEN tipo I, IIa, IIb .
Disminuido:
Alcoholismo, sarcoidosis, tuberculosis pulmonar, SIDA; malaria, cáncer
de esófago, carcinoma de mama, de vejiga, tumor metastásico,
linfoma, mieloma múltiple, hipomagnesemia, hipercalciuria idiopática,
falla renal aguda, falla renal crónica, hipoparatiroidismo, síndrome
de Di George, hipoparatiroidismo autoinmune, hipoparatiroidismo quirúrgico
asociado a tiroidectomía, hipomagnesemia, hipocalcemia neonatal
transitoria, diálisis, urémicos, transplantados renales,
hipertiroidismo, hipercalcemia no paratiroidea en la ausencia de falla
renal, nefrolitiasis, pre-eclampsia, artritis reumatoidea.
Variables por drogas:
Aumentado:
Anticonvulsivantes, corticoides, isoniacida, carbonato de litio (terapia
crónica), fosfatos, rifampicina, furosemida, prednisona, dopamina,
25-hidroxivitamina D, pamidronato, glucosa.
Disminuido:
Cimetidina, pindolol, propanolol, hidróxido de aluminio, gentamicina,
calcitriol, famotidina, ingestión de calcio.
Bibliografía:
1- LotharT. Clinical Laboratory Diagnostics: Use and assessment of clinical
laboratory results, English edition, 1998.
2- Tietz N. W. Clinical Guide to Laboratory test, edited by W.B. Saunders
Company, third edition, United States of America ,1995.
3- Young D. Effects of Preanalytical Variables on Clinical Laboratory
Test . AACC, second edition, 1997.
4- Young D. and Friedman R. Effects of Disease on Clinical Laboratory
Test, edited by AACC, third edition, 1997.
5- Burtis C. and Ashwood E. Tietz Textbook of Clinical Chemestry, W.B.
Saunders Company, third edition, United States of America,1999.
6- Young D. Effects of Drugs on Clinical Laboratory Test, AACC, third
edition, 1990.
|